جزوات مدرسه
روند تغییر شعاع اتمی در جدول تناوبی:
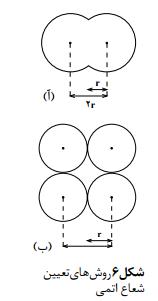
بیشتر فضای اتم خالی است. در واقع الکترونها در محدودههایی حرکت میکنند که شبیه به ابر به نظر میرسند. با این تشبیه میتوان تصور کرد که تا چه اندازه، اندازهگیری ابعاد اتمها دشوار است، زیرا مرزهای یک تودۀ ابر مانند، نامشخص و متغیر است. اندازۀ یک اتم به وسیلۀ شعاع آن تعیین میشود. بنا بر تعریف به نصف فاصلۀ میان هستۀ دو اتم مشابه در یک مولکول دو اتمی شعاع اتمی گفته میشود. بر اساس این تعریف تعیین شعاع برخی از اتمها در شکل 6 نشان داده شده است. در روش دیگری برای تعیین شعاع اتمها از اندازهگیری فاصلۀ بین اتمی در بلور یک عنصر استفاده میشود. به دلیل همین تنوع در روشهای تعیین شعاعهای اتمی جدولهای مربوط به این مقادیر معمولاً با یک دیگر اندکی تفاوت دارند. توجه داشته باشید که در شکل 6 اتمها به صورت گویهای سادهای تصور شدهاند. آیا تغییر شعاع اتمی عنصرها از یک روند تناوبی برخوردار است؟ در شکل 7 شعاع اتمی عنصرهای گروههای اصلی آمده است. به نظر شماشعاع اتمی عنصرها در هر گروه از جدول تناوبی چگونه تغییر میکند؟ اگر به آرایش الکترونی عنصرهای جدول توجه کنیم متوجه میشویم که با حرکت از باال به پایین در یک گروه جدول به ازای هر تناوب یک لایه الکترونی جدید به تعداد لایه های الکترونی عنصرها افزوده میشود. بنابراین، شعاع اتمی به دو دلیل در یک گروه از عنصرها افزایش مییابد: آ( با زیادشدن لایه های الکترونی، شعاع اتمی نیز افزایش مییابد. به عبارت دیگر، الکترونها در فاصلههای دورتری نسبت به هسته قرار میگیرند.
بقیه روند ها در ادامه مطلب
ب)در یک گروه از بالا به پایین با افزایش عدد اتمی بار مثبت هسته افزایش مییابد، اما همزمان نیز تعداد الکترونها در لایه های موجود میان هسته و لایه الکترونی بیرونی (لایه ظرفیت) اتم، افزایش مییابد. وجود الکترونها درلایه های درونی و دافعۀ آنها با الکترونهای لایه ظرفیت، از تأثیر نیروی جاذبۀ هسته بر الکترونهای موجود در لایه الکترونی بیرونی میکاهند و همزمان با افزایش فاصلۀ الکترونهای بیرونی از هسته افزایش شعاع اتمی را سبب میشود. به این پدیده اثر پوششی الکترونهای درونی گفته میشود. این اثر پوششی سبب میشود که هسته بر الکترونهای لایه بیرونی نیروی جاذبۀ کمتری اعمال کند. از این رو، این الکترونها تحرک بیشتری نسبت به الکترونهای درونی دارند و به این دلیل میتوانند در فواصل دورتری از هسته حضور یابند.
روند تناوبی انرژی یونش در جدول تناوبی:
در یک گروه از بالا به پایین با افزایش اندازۀ اتم انرژی نخستین یونش کم میشود، زیرا الکترون موجود در بیرونی ترین لایه الکترونی اتم در فاصلۀ دورتری از هسته قرار گرفته است و بنابراین جداشدن آن از اتم، به صرف انرژی کمتری نیاز دارد. اما، در طول یک دوره از جدول تناوبی انرژی یونش به طور کلی از چپ به راست افزایش مییابد، زیرا در این جهت بار مؤثر هستۀ اتمها رو به افزایش است و به این ترتیب اندازۀ اتم ها به تدریج کوچکتر میشود. در این شرایط جدا شدن الکترون از اتم به صرف انرژی بیشتری نیاز خواهد داشت.